
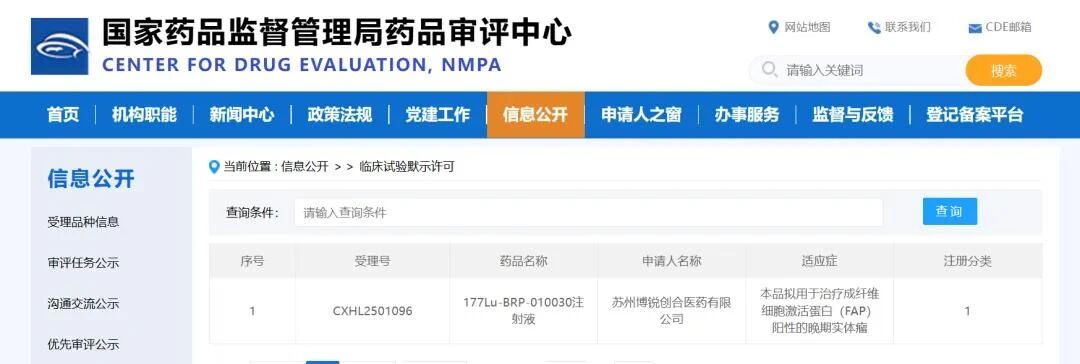
由苏州博锐创合医药有限公司(下称“博锐创合”)研发的“177Lu-BRP-010030注射液”近日获国家药品监督管理局(NMPA)临床试验默示许可(受理号CXHL2501096),用于治疗成纤维细胞激活蛋白(FAP)阳性的晚期实体瘤。该品种是全球唯一获批的基于靶向共价技术的治疗性放射性药物。
益诺思受博锐创合委托,遵循 NMPA、 ICH 及 FDA 指导原则,在符合 NMPA 及 FDA 标准的 GLP 实验室环境中,为“177Lu-BRP-010030注射液提供了全面的非临床安全性评价及药代动力学研究。 益诺思的专业团队以科学严谨的态度和高效精准的技术操作,助力其顺利获批,进入临床试验。
关于CTR-FAPI
CTR-FAPI(BRP-010)是一款高度差异化的靶向成纤维细胞激活蛋白(FAP)的新型诊疗一体化药物,采用专利的靶向共价放射配体(Covalent Targeted Radioligand, CTR)技术开发,是目前全球唯一处于临床阶段的共价放射性药物,用于FAP阳性实体瘤的诊断及治疗。CTR-FAPI 通过“SuFEx”修饰实现了对靶蛋白不可逆的共价连接。临床前和初步临床数据一致显示,CTR-FAPI具有更高的肿瘤摄取,更佳的成像对比度、更长的肿瘤滞留、更强的治疗潜力。
关于博锐创合

关于益诺思

Copyright © 2017-2021©Shanghai InnoStar Bio-tech Co., Ltd. All Rights Reserved. Created By VPABrand.com